ABCB5 als Marker für hoch potente mesenchymale Stammzellen
Im Jahr 2003 beschrieben Wissenschaftler unter der Leitung von Prof. Dr. Markus Frank am Boston Children's Hospital (Lehrkrankenhaus der Harvard Medical School, Boston, Massachusetts), eine neue, bislang noch nicht charakterisierte Gruppe mesenchymaler Stammzellen, die ABCB5 in der menschlichen Haut exprimieren. Diese Zellen verfügen über einzigartige immunmodulierende Eigenschaften, durch die sie ein herausragendes Potenzial für die Behandlung entzündlicher und degenerativer Erkrankungen besitzen.
Entzündungshemmung:
der wesentliche Mechanismus von ABCB5
Eines der führenden Probleme bei nicht behandelbaren Erkrankungen ist eine lokale oder systemische Entzündung, die die körpereigene Regeneration verhindert.
ABCB5-positive Stammzellen wirken bei Patienten entzündungshemmend, da sie in eine Wechselwirkung mit Immunzellen (Makrophagen, T-Zellen, Neutrophile) treten und das vormals entzündungsfördernde Umfeld zum Positiven verändern. Somit erhält der Körper die Chance zu heilen.
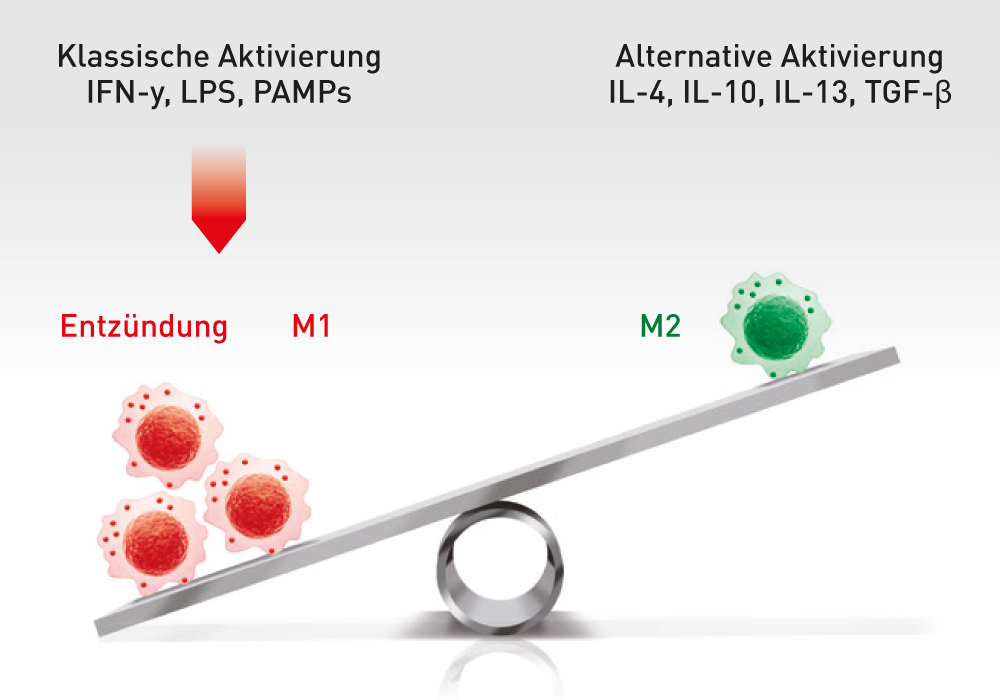
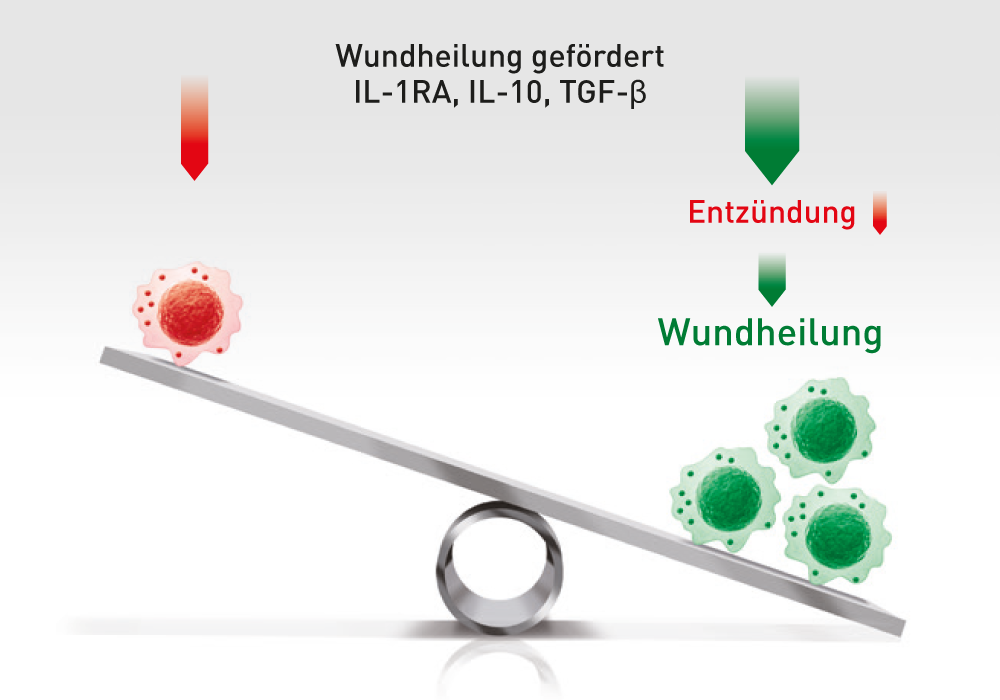
ABCB5+ mesenchymalen Stammzellen lösen den Wechsel von entzündungsfördernden M1- zu entzündungshemmenden M2-Makrophagen aus
Von lokaler Entzündung zum Zytokinsturm: unsere Geschichte
Auf der Grundlage wissenschaftlicher Evidenz konzentrierten wir uns bei Patienten mit chronischen Wunden anfangs auf die lokale Entzündung, um den Wirkmechanismus zu validieren.
Basierend auf den erlangten Kenntnissen aus den klinischen Studien mit topischer Verabreichung und weiteren Forschungsprogrammen, erweiterten wir unseren klinischen Fokus auf systemisch entzündliche Erkrankungen.
In Zusammenarbeit mit weltweit führenden Experten entwickelten wir ein klinisches Entwicklungsprogramm, das sich auf den ungedeckten medizinischen Bedarf bei einer seltenen Erkrankung im Kindesalter mit starker systemischer Entzündung konzentriert.
Die Erkenntnisse über die Art und Weise, wie unsere Stammzellen Entzündungsvorgänge modulieren können, motivierten uns dazu, mit unserem klinischen Programm den nächsten Schritt zu gehen: der Erforschung einer lebensbedrohlichen Situation, begleitet von einer massiven systemischen Entzündung, die zum Zytokinsturm und schließlich zum Tod führen kann.
Lokalisierte
Entzündungen
z.B. chronische, nicht heilende Wunden
Generalisierte
entzündliche Prozesse


z.B. rezessive dystrophische Epidermolysis bullosa
Lebensbedrohende
systemische Entzündungen

z.B. akut-auf-chronisches Leberversagen
Vom Labor zum Patienten: allogene Stammzelltherapeutika
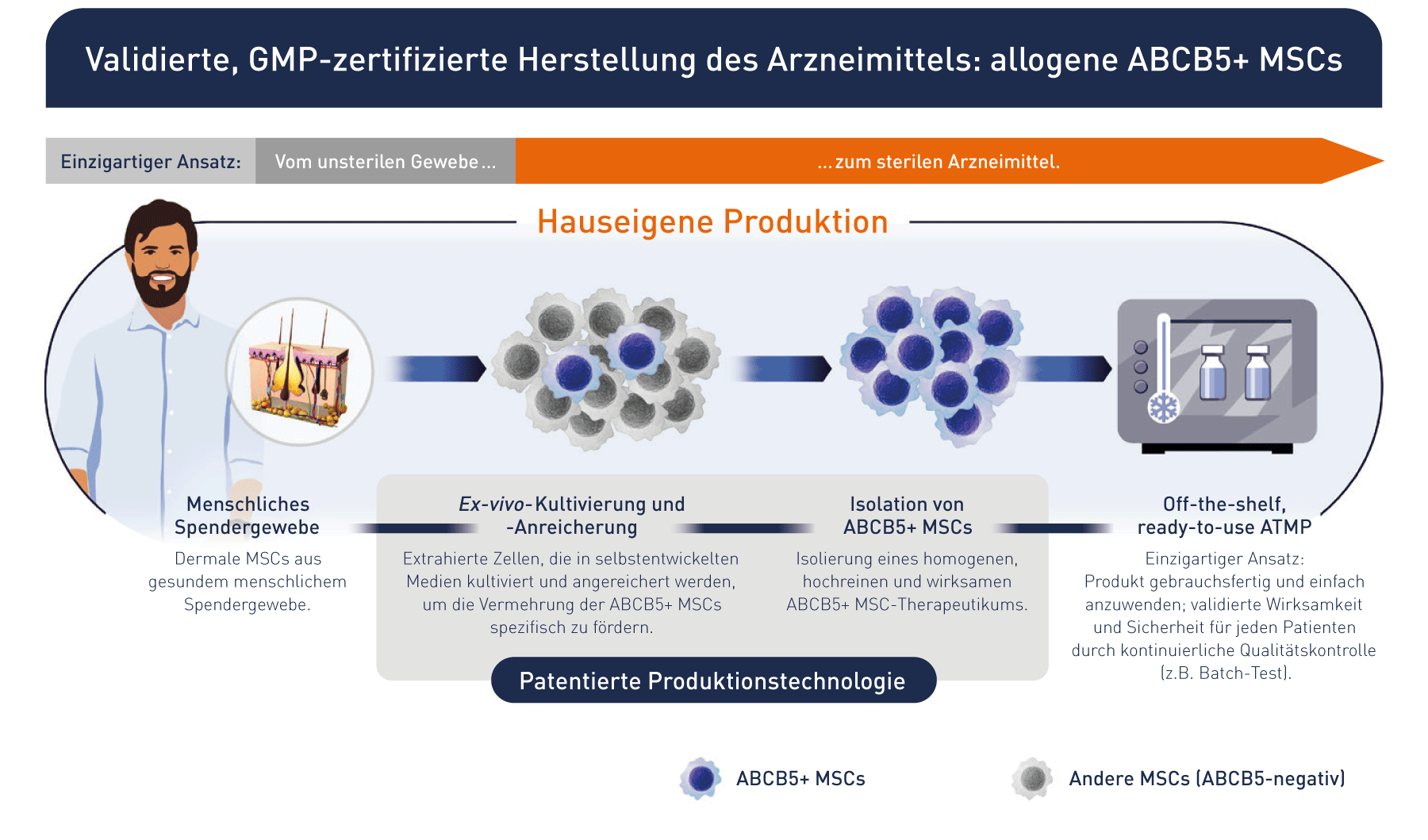
Basierend auf unseren Forschungsergebnissen entwickelten wir einen einzigartigen patentierten Herstellungsprozess, in dem ABCB5-positive Zellen als hochreine und hoch potente Subpopulation von mesenchymalen Stammzellen nach vorgegebenen Qualitäts- und Freigabekriterien produziert und isoliert werden. So kommt unser Medikament zum Patienten.
Wie funktioniert der ABCB5+ MSC-Ansatz von RHEACELL?
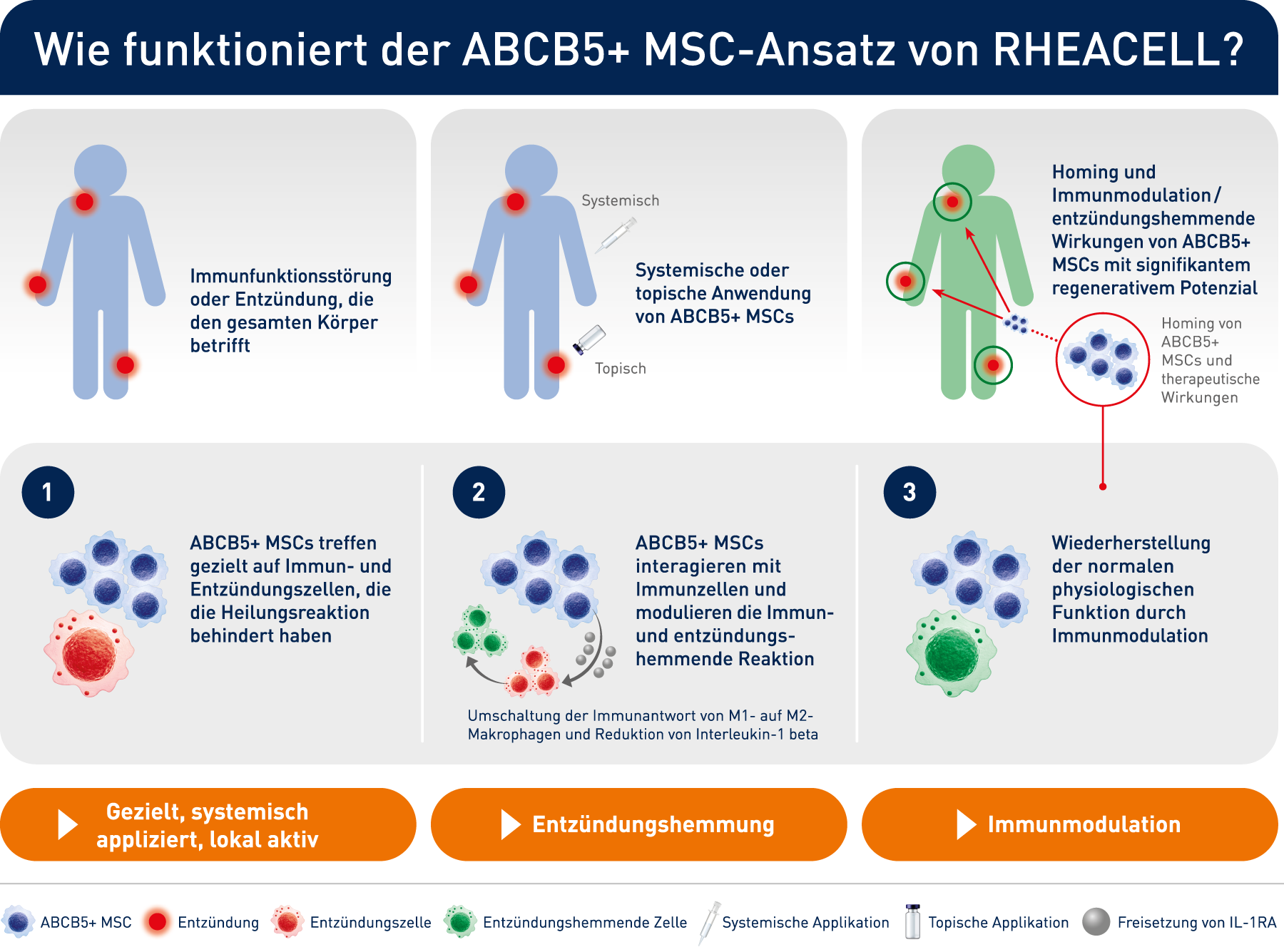
Die Technologie hinter der klinischen Anwendung: Pionier und Experte bei der Herstellung eines einzigartigen und wirksamen Stammzellarzneimittels
Hochwertige Stammzellen unter Verwendung unseres eigens entwickelten und validierten GMP-Herstellungsverfahrens und Qualitätskontrolle zur Erzeugung einer definierten und einzigartigen Stammzelle gemäß AMG (Arzneimittelgesetz) zur Herstellung eines ATMP (Advanced Therapy Medicinal Product).
RHEACELL hat die exklusive Lizenz für das gesamte Patentportfolio der ABCB5-Gen- und Proteinfamilie vom Boston Children's Hospital, einem Lehrkrankenhaus der Harvard Medical School, Boston, Massachusetts (über 37 exklusive Patente).
Unsere wichtigen Forschungsergebnisse über die ABCB5-positiven Stammzellen wurden in einigen der führenden wissenschaftlichen Fachzeitschriften veröffentlicht. Daraus resultierten unsere "High-end" Freigabekriterien für die klinische Effizienz.
Off-the-Shelf & Ready-to-Use: Wir bilden die gesamte Kette - von der Produktion bis hin zum Patienten - ab
Mit weltweit patentierter Technologie und firmeneigenem Know-how produzieren wir Stammzellen in größten Mengen, um den Anforderungen des Marktes jederzeit und überall gewachsen zu sein.
Etablierte und anerkannte Technologie mit hohem Potenzial: bereit für die Zelltherapeutika der nächsten Generation
Wir nutzen unsere eigene, etablierte und patentierte Stammzellplattform um Technologien der nächsten Generation Zelltherapeutika (CRISPR / Cas, iPS Technology, 3D Bioprinting...) zu entwickeln.
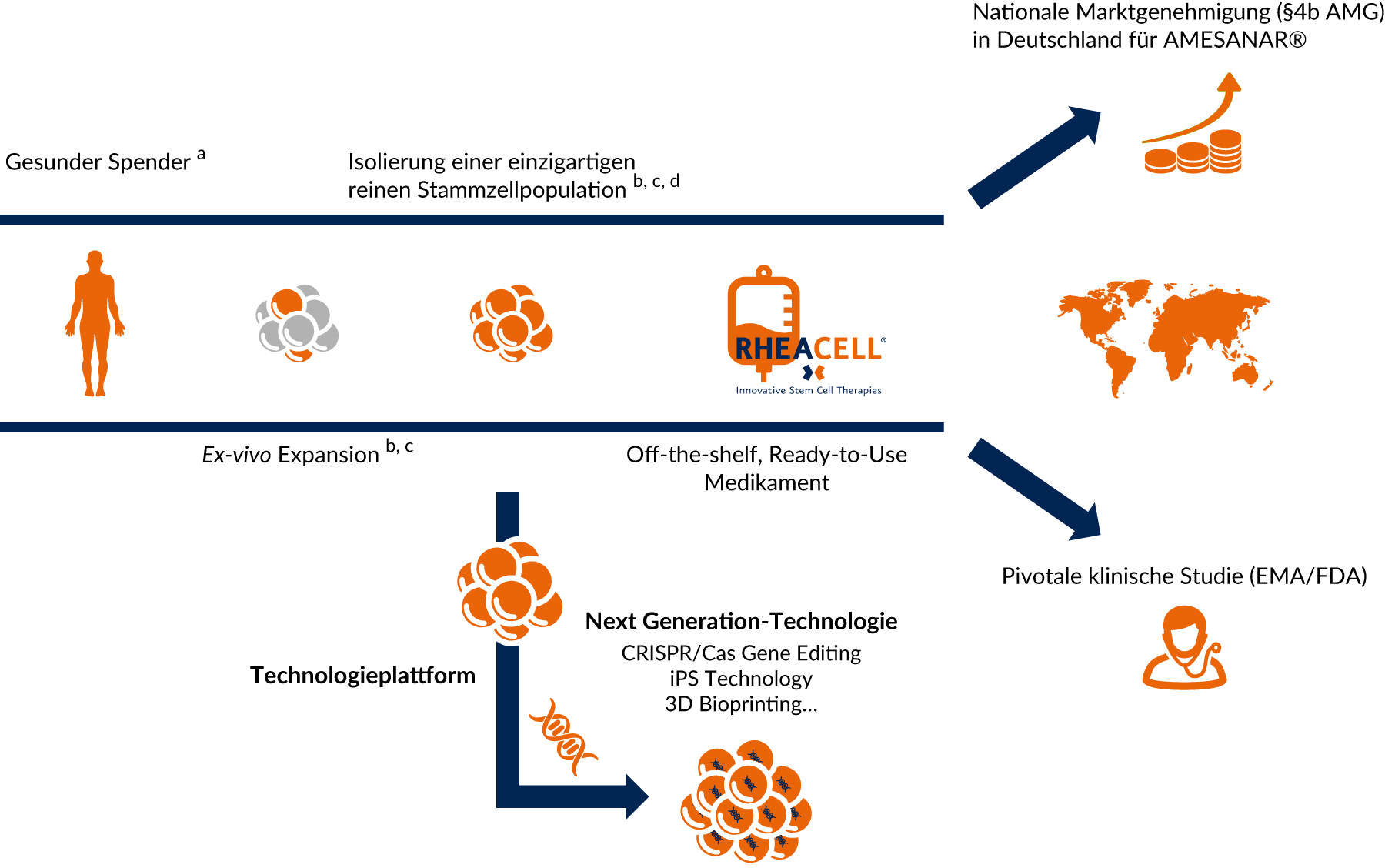
a Behördenregulierte Entnahmezentren
b Patentierte Technologie: 37 exklusive Patente (Harvard University)
c Ballikaya et al., Stem Cell Res Ther. 2020/Kerstan et a., Cytotherapy. 2021
d Isolierung von ABCB5-positiven mesenchymalen Stammzellen